I. Lớp và phân lớp electron
Trong nguyên tử, các electron sắp xếp thành từng lớp và phân lớp theo năng lượng từ thấp đến cao
a. Lớp electron
- Các electron thuộc cùng một lớp có năng lượng gần bằng nhau
- Lớp electron được kí hiệu là các số thứ tự 1, 2, 3…, 7 với tên gọi là các chữ in hoa như sau:
| n | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| Tên lớp | K | L | M | N | O | P | Q |
b. Phân lớp electron
- Mỗi lớp electron phân chia thành các phân lớp, được kí hiệu bằng các chữ cái thường: s, p, d, f
- Các electron thuộc các phân lớp s, p, d, f được gọi tương ứng là các electron s, electron p, electron d, electron f
- Các electron thuộc cùng một phân lớp có năng lượng bằng nhau. Với 4 lớp đầu (1, 2, 3, 4) số phân lớp trong mỗi lớp bằng số thứ tự của lớp đó. Cụ thể
+ Lớp thứ nhất (lớp K, n=1) có 1 phân lớp s
+ Lớp thứ hai (lớp L, n=2) có 2 phân lớp s, p
+ Lớp thứ ba (lớp M, n=3) có 3 phân lớp s, p, d
+ Lớp thứ tư (lớp N, n=4) có 4 phân lớp s, p, d, f
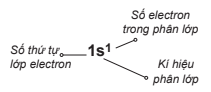
- Số electron của phân lớp được ghi bằng số ở phía bên phải của phân lớp (s2, p6)
c. Số electron tối đa trong một phân lớp, trong một lớp
- Số electron tối đa trong một phân lớp
|
|
Phân lớp s |
Phân lớp p |
Phân lớp d |
Phân lớp f |
|
Số e tối đa = 2 x số AO |
2.1 = 2 |
2.3 = 6 |
2.5 = 10 |
2.7 = 14 |
|
Cách ghi |
s2 |
p6 |
d10 |
f14 |
+ Phân lớp đã đủ số electron tối đa gọi là phân lớp electron bão hòa.
- Số electron tối đa trong một lớp
|
|
Lớp K |
Lớp L |
Lớp M |
Lớp N |
|
Thứ tự |
n = 1 |
n = 2 |
n = 3 |
n = 4 |
|
Số phân lớp |
1s |
2s 2p |
3s 3p 3d |
4s 4p 4d 4f |
|
Số e tối đa (2.n2) |
2 |
8 |
18 |
32 |
+ Lớp electron đã đủ số electron tối đa gọi là lớp electron bão hòa
+ Lớp electron bão hòa khi các phân lớp trong lớp đó đã bão hòa
II. Cấu hình electron của nguyên tử
a. Khái niệm
Cấu hình electron của nguyên tử biểu diễn sự phân bố electron trên các phân lớp thuộc các lớp khác nhau
b. Các nguyên lý, quy tắc áp dụng cho việc viết cấu hình electron
- Nguyên lý vững bền: Các electron nguyên tử ở trạng thái cơ bản lần lượt chiếm các mức năng lượng từ thấp đến cao
- Nguyên lý Pauli: Trên 1 orbital nguyên tử chứa tối đa 2 electron và có chiều tự quay khác chiều nhau xung quanh trục riêng của mỗi electron
- Quy tắc Hund: Trong cùng 1 phân lớp, các electron điền vào các orbital sao cho số electron độc thân là lớn nhất
c. Cách viết cấu hình electron nguyên tử
- Bước 1: Xác định số electron trong nguyên tử
- Bước 2: Viết thứ tự các lớp và phân lớp electron theo chiều tăng của năng lượng:
- Bước 3: Điền các electron vào các phân lớp theo nguyên lý vững bền cho đến electron cuối cùng
Ví dụ: Viết cấu hình electron của nguyên tử K (Z=19)
- Bước 1: Tổng số electron của nguyên tử K là 19
- Bước 2: Viết thứ tự các lớp và phân lớp electron đến phân lớp 4s theo chiều tăng của năng lượng: 1s2s2p3s3p4s
- Bước 3: Điền các electron: 1s22s22p63s23p64s1
d. Biểu diễn cấu hình electron theo ô orbital
- Ý nghĩa: Biểu diễn cấu hình electron theo ô orbital là một cách biểu diễn sự phân bố electron theo orbital, từ đó biết được số electron độc thân của nguyên tử
- Cách biểu diễn:
+ Bước 1: Viết cấu hình electron của nguyên tử
+ Bước 2: Biểu diễn mỗi AO bằng một ô vuông, các AO trong cùng phân lớp thì viết liền nhau, câc AO khác phân lớp thì viết tách nhau. Thứ tự các ô orbital từ trái sang phải theo thứ tự như ở cấu hình electron
+ Bước 3: Điền electron vào từng ô orbital theo thứ tự lớp và phân lớp, mỗi electron biểu diễn bằng một mũi tên. Trong mỗi phân lớp, electron được phân bố sao cho số electron độc thân là lớn nhất, electron được điền vào các ô orbital theo thứ tự từ trái sang phải. Trong một ô orbital, electron đầu tiên được biểu diễn bằng mũi tên quay lên, electron thứ hai được biểu diễn bằng mũi tên quay xuống
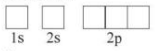
Ví dụ: Biểu diễn cấu hình theo ô orbital của C
+ Bước 1: Cấu hình electron của C: 1s22s22p2
+ Bước 2: Biểu diễn AO
+ Bước 3: Điền electron vào từng ô orbital
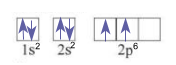
Như vậy, nguyên tử carbon có 2 electron độc thân thuộc AO 2p
III. Dự đoán tính chất hóa học cơ bản của nguyên tố dựa theo cấu hình electron
- Nguyên tố mà nguyên tử đủ 8 electron lớp ngoài cùng là khí hiếm (trừ He)
- Nguyên tố mà nguyên tử có 1, 2, 3 electron lớp ngoài cùng thường là nguyên tố kim loại
- Nguyên tố mà nguyên tử có 5, 6, 7 electron lớp ngoài cùng thường là nguyến tố phi kim

