I. Thành phần nguyên tử

- Nguyên tử gồm hạt nhân và vỏ nguyên tử
- Hạt nhân nguyên tử: ở tâm của nguyên tử, chứa các proton mang điện tích dương và các neutron không mang điện (trừ nguyên tử 1H trong hạt nhân không có neutron)
- Vỏ nguyên tử: chứa các electron mang điện tích âm, chuyển động rất nhanh xung quanh hạt nhân
|
|
Hạt nhân |
Vỏ nguyên tử |
|
|
Proton (p) |
Neutron (n) |
Electron (e) |
|
|
Khối lượng (m) |
1,6726.10-27 kg = 1u |
1,6748.10-27 kg = 1u |
9,1094.10-31 kg = 0,00055u |
|
Điện tích (q) |
1,602.10-19 C = 1+ |
0 |
– 1,602.10-19 C = 1– |
- Do số proton bằng số electron nên nguyên tử trung hòa về điện
II. Sự tìm ra electron
- Thí nghiệm của Thomson: Năm 1897, nhà vật lí người Anh J.J Thomson thực hiện thí nghiệm phóng điện trong một ống thủy tinh gần như chân không (gọi là ống tia âm cực). Ông quan sát thấy màn huỳnh quang trong ống phát sáng do những tia phát ra từ cực âm (gọi là tia âm cực) và những tia này bị hút về cực dương của trường điện, chứng tỏ chúng tích điện âm. Đó chính là chùm các hạt electron
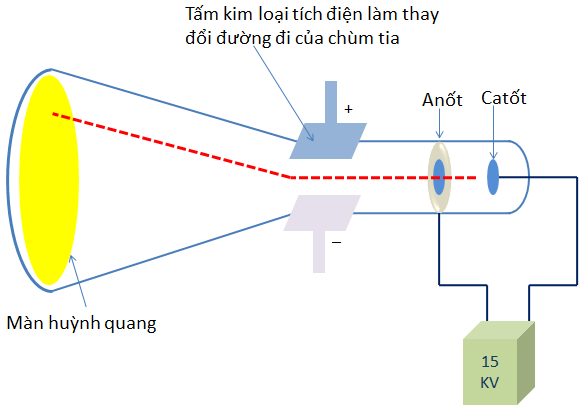
- Đặc điểm của electron:
+ Điện tích âm, kí hiệu là e
+ Điện tích: qe=-1,602.10-19 C (quy ước là -1)
+ Khối lượng: me=9,11.10-31 kg
III. Sự khám phá hạt nhân nguyên tử
- Thí nghiệm của Rutherford: Năm 1911, nhà vật lí người New Zealand là E.Rutherford đã tiến hành bắn phá một chùm hạt alpha lên một lá vàng siêu mỏng và quan sát đường đi của chúng sau khi bắn phá bằng màn huỳnh quang
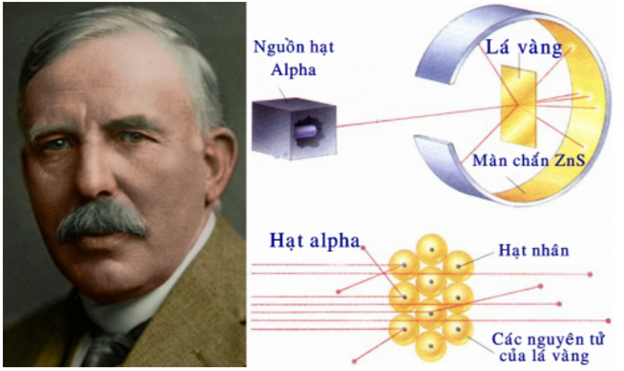
- Đặc điểm:
+ Nguyên tử có cấu tạo rỗng, gồm hạt nhân ở trung tâm và lớp vỏ là các electron chuyển động xung quanh hạt nhân.
+ Nguyên tử trung hòa về điện: số đơn vị điện tích dương của hạt nhân bằng số đơn vị điện tích âm của các electron trong nguyên tử
IV. Cấu tạo và điện tích hạt nhân nguyên tử
|
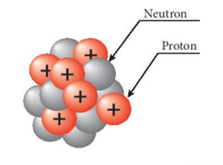
- Cấu tạo hạt nhân nguyên tử: gồm hai loại hạt là proton (mang điện tích dương) và neutron (không mang điện). - Proton mang điện tích 1+, nếu hạt nhân có Z proton thì điện tích hạt nhân bằng Z+ - Số đơn vị điện tích hạt nhân (Z)=Số hiệu nguyên tử=Số electron (e)=Số proton (p)
|
 |
V. Khối lượng và kích thước của nguyên tử
- Khối lượng và kích thức của nguyên tử vô cùng nhỏ.
- Một cách gần đúng, có thể coi khối lượng nguyên tử bằng khối lượng của hạt nhân. Do khối lượng của các electron (0,00055 amu) rất nhỏ so với khối lượng của proton hay neutron (1 amu).
- Khối lượng nguyên tử thường được biểu thị theo đơn vị khối lượng nguyên tử, kí hiệu amu
Khối lượng tính ra kg của 1 nguyên tử carbon-12 là 19,926.10-27 kg
1 amu được định nghĩa bằng khối lượng 1 nguyên tử carbon-12
\(1amu = \frac{{19,{{926.10}^{ - 27}}kg}}{{12}} = 1,{661.10^{ - 27}}kg\)
- Kích thước của nguyên tử thường được biểu diễn bằng đơn vị nanomet (nm) hay angstrom (\(\mathop A\limits^o \))
1nm=10-9 m: 1\(\mathop A\limits^o \)=10-10 m; 1nm=10\(\mathop A\limits^o \)

