I. Cấu tạo và điện tích hạt nhân nguyên tử
|
- Cấu tạo hạt nhân nguyên tử: gồm hai loại hạt là proton (mang điện tích dương) và neutron (không mang điện). - Proton mang điện tích 1+, nếu hạt nhân có Z proton thì điện tích hạt nhân bằng Z+ - Số đơn vị điện tích hạt nhân (Z)=Số hiệu nguyên tử=Số electron (e)=Số proton (p)
|
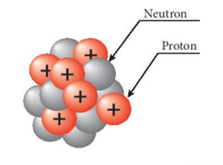 |
II. Số khối
- Là tổng số hạt proton và neutron của hạt nhân đó
- Kí hiệu: A
- Công thức: A=Z+N
III. Nguyên tố hóa học
a. Định nghĩa: Nguyên tố hóa học là tập hợp những nguyên tử có cùng điện tích hạt nhân (cùng số proton, số electron)
- Ví dụ: Protium, Deuterium và Tritium là các loại nguyên tử của nguyên tố hydrogen
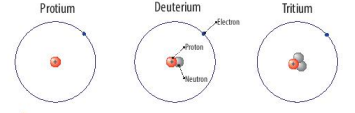
b. Số hiệu nguyên tử
- Số đơn vị điện tích hạt nhân nguyên tử của một nguyên tố được gọi là số hiệu nguyên tử của nguyên tố đó
- Kí hiệu: Z
IV. Kí hiệu nguyên tử
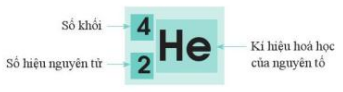
- Kí hiệu: \({}_Z^AX\)
Trong đó:
X: kí hiệu của nguyên tố
Z: số hiệu nguyên tử (bằng số proton, bằng số electron)
A: số khối (A=Z+N)
- Ví dụ:
V. Đồng vị
- Các đồng vị của cùng một nguyên tố hóa học là những nguyên tử có cùng số proton nhưng khác nhau về số neutron, do đó số khối A của chúng khác nhau
- Ví dụ: Nguyên tố H có 3 đồng vị là \({}_1^1H,{}_1^2H,{}_1^3H\)
VI. Nguyên tử khối
a. Nguyên tử khối
- Nguyên tử khối là khối lượng tương đối của nguyên tử
- Khối lượng của một nguyên tử bằng tổng khối lượng của proton, neutron và electron trong nguyên tử đó. Do khối lượng của electron quá nhỏ so với hạt nhân nên có thể bỏ qua. Vì vậy có thể coi nguyên tử khối có giá trị bằng số khối
- Ý nghĩa: Nguyên tử khối của một nguyên tử cho biết khối lượng của nguyên tử đó nặng gấp bao nhiêu lần đơn vị khối lượng nguyên tử (1 amu)
b. Nguyên tử khối trung bình
X có 2 đồng vị \({}_Z^{{A_1}}X\) chiếm x1 % tổng số nguyên tử và \({}_Z^{{A_2}}X\) chiếm x2 % tổng số nguyên tử
\( \Rightarrow \mathop M\limits^\_ = \frac{{{x_1}.{A_1} + {x_2}.{A_2}}}{{100}}\)
Trong đó:
A1 và A2 là số khối của 2 đồng vị
x1 và x2 là phần trăm số nguyên tử của 2 đồng vị

