Dẫn 0,55 mol hỗn hợp X (gồm hơi nước và khí CO2) qua cacbon nung đỏ thu được 0,95 mol hỗn hợp Y gồm CO, H2 và CO2. Cho Y hấp thụ vào dung dịch chứa 0,1 mol Ba(OH)2 sau khi phản ứng xảy ra hoàn toàn, thu được m gam kết tủa. Giá trị của m là
Trả lời bởi giáo viên
Ta thấy nC = nY - nX = 0,95 - 0,55 = 0,4 mol
Oxi hóa hoàn toàn hỗn hợp Y thì:
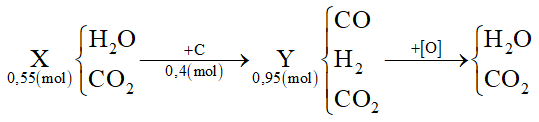
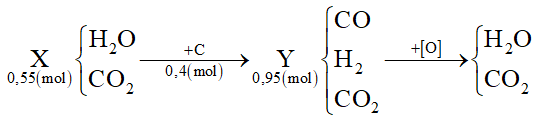
Áp dụng bảo toàn e cho toàn bộ quá trình thì: 4nC = 2nO → nO = 0,8 mol
Mà nO = ∑nCO(Y), H2(Y) = 0,8 mol ⟹ nCO2(Y) = 0,95 - 0,8 = 0,15 mol
Khi cho Y phản ứng với Ba(OH)2 tức là 0,15 mol CO2 phản ứng với 0,1 mol Ba(OH)2:
Tỉ lệ: 1 < nOH-/nCO2 = 0,2/0,15 = 1,33 < 2 → tạo CO32- (a) và HCO3- (b)
Giải hệ: \(\left\{ \begin{array}{l}{n_{C{O_2}}} = a + b = 0,15\\{n_{O{H^ - }}} = 2{\rm{a}} + b = 0,2\end{array} \right. \to \left\{ \begin{array}{l}a = 0,05\\b = 0,1\end{array} \right.\)
Ba2+ + CO32- → BaCO3
0,05 ← 0,05 → 0,05
→ m ↓ = 0,05.197 = 9,85 gam
Hướng dẫn giải:
Tính được nC = nY - nX
Oxi hóa hoàn toàn hỗn hợp Y thì:

Áp dụng bảo toàn e cho toàn bộ quá trình sẽ tính được số mol O (cần dùng để oxi hóa hết Y)
Mà nO = ∑nCO(Y), H2(Y) ⟹ số mol CO2 trong Y
Sau đó giải tương tự như bài toán hấp thụ CO2 vào dung dịch kiềm

