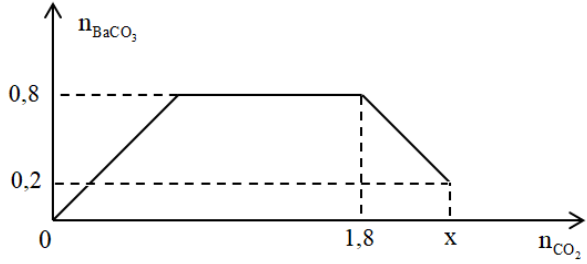
Cho từ từ x mol khí CO2 vào 500 gam dung dịch hỗn hợp KOH và Ba(OH)2. Kết quả thí nghiệm được biểu diễn trên đồ thị sau:
Tổng nồng độ phần trăm khối lượng của các chất tan trong dung dịch sau phản ứng là
Trả lời bởi giáo viên
Tại điểm A: nkết tủa = nBa2+ = nCO2 = 0,8 mol → nBa(OH)2 = 0,8 mol
Tại điểm B: kết tủa bắt đầu tan:
nCO3(2-) = nOH- - nCO2
⟹ 0,8 = nOH- - 1,8 → nOH- = 2,6 mol → nKOH = 2,6 - 0,8.2 = 1 mol
Tại điểm C: Kết tủa tan 1 phần:
nCO3(2-) = nOH- - nCO2
⟹ 0,2 = 2,6 - nCO2 → nCO2 = 2,4 mol
Dung dịch sau phản ứng có: 0,6 mol Ba2+; 1 mol K+; 2,2 mol HCO3- (áp dụng định luật bảo toàn điện tích)
⟹ mchất tan = 0,6.137 + 1.39 + 2,2.61 = 255,4 gam
Tương tự tìm mdd = mcác chất tham gia pứ - mkết tủa = 2,4.44 + 500 - 0,2.197 = 566,2 (gam)
⟹ C%chất tan = \(\frac{{255,4}}{{566,2}}.100\% \)= 45,11%
Hướng dẫn giải:
Tại điểm A: nkết tủa = nBa2+ = nCO2
Tại điểm B: kết tủa bắt đầu tan 1 phần: nCO3(2-) = nOH- - nCO2
Tại điểm C: Kết tủa tan 1 phần: nCO3(2-) = nOH- - nCO2. Khi đó tính được số mol CO2.
Dung dịch sau phản ứng có: Ba2+, K+, HCO3-
Ta có: mdd = mcác chất tham gia pứ - mkết tủa ⟹ C%chất tan

