Cho hỗn hợp A gồm Fe và FeS tác dụng với dung dịch HCl dư thu được 2,24 lít hỗn hợp khí X ở điều kiện tiêu chuẩn. Hỗn hợp khí này có tỉ khối so với hiđro là 9. Thành phần phần trăm theo khối lượng của hỗn hợp Fe và FeS ban đầu lần lượt là
Trả lời bởi giáo viên
Mhh khí = 9.2=18 (g/mol)
nhh khí = V/22,4= 0,1 mol
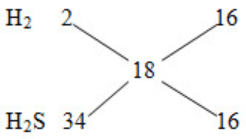
=> nH2= nH2S = 0,05 mol
Fe + 2HCl→FeCl2 +H2
0,05 0,05
FeS +2HCl →FeCl2 + H2S
0,05 0,05
=> mA = mFe + mFeS = 0,05.56 + 0,05.88=7,2 g
\(\% {m_{Fe}} = \frac{{{m_{Fe}}}}{{{m_A}}}.100\% = \frac{{0,05.56}}{{7,2}}.100\% = 38,89\% \)
%mFeS = 100%- %mFe= 61,11%
Hướng dẫn giải:
Mhh khí = 9.2=18 (g/mol)
nhh khí = V/22,4= 0,1 mol
Dùng quy tắc đường chéo, tính được từng mol H2, H2S
PTHH:
Fe + 2HCl→FeCl2 +H2
FeS +2HCl →FeCl2 + H2S
Tính số mol Fe, FeS theo số mol H2 ; H2S
=> mA = mFe + mFeS
=> %mFe, %mFeS

