Câu hỏi:
3 năm trước
Cho 2,4 gam Mg vào dung dịch chứa 0,3 mol HCl. Tính thể tích khí H2 thu được ở điều kiện tiêu chuẩn. Biết phương trình hóa học của phản ứng là:
Mg + 2HCl → MgCl2 + H2
Trả lời bởi giáo viên
Đáp án đúng: a
Số mol Mg là: ${n_{Mg}} = \dfrac{{2,4}}{{24}} = 0,1(mol)$
PTHH: Mg + 2HCl → MgCl2 + H2
Xét tỉ lệ: $\dfrac{{{n_{Mg}}}}{1} = \dfrac{{0,1}}{1} = 0,1$ và $\dfrac{{{n_{HCl}}}}{2} = \dfrac{{0,3}}{2} = 0,15$
Vì 0,1 < 0,15 => Mg phản ứng hết, HCl dư
=> phản ứng tính theo Mg
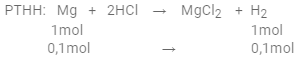
$ = > {V_{{H_2}}} = 0,1.22,4 = 2,24(l)$
Hướng dẫn giải:
+) Tính số mol Mg
+) Viết PTHH
+) Xét tỉ lệ: $\dfrac{{{n_{Mg}}}}{1}$ và $\dfrac{{{n_{HCl}}}}{2}$ => chất dư, chất hết
=> tính H2 theo chất hết

