Khử 3,48 gam một oxit của kim loại M cần dùng 1,344 lít H2 (đktc). Toàn bộ lượng kim loại M sinh ra cho tác dụng với dung dịch HCl dư thu được 1,008 lít H2 (đktc). Công thức oxit là
Trả lời bởi giáo viên
${n_{{H_2}}} = \frac{{1,344}}{{22,4}} = 0,06\,mol$
TH1: M không phải là Fe3O4
M2On + nH2 $\xrightarrow{{{t^o}}}$ 2M + nH2O
$\frac{{0,06}}{n}$ ←0,06 → $\frac{{0,12}}{n}$
$ = > {M_{{M_2}{O_n}}} = \dfrac{{3,48}}{{\dfrac{{0,06}}{n}}} = 58n$
=> 2M + 16n = 58n => M = 21n
Ta có bảng sau:
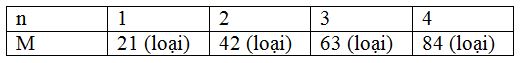
=> loại trường hợp này
TH2: M là Fe3O4 $ = > {n_{F{{\text{e}}_3}{O_4}}} = \dfrac{{3,48}}{{232}} = 0,015\,mol$
Fe3O4 + 4H2 $\xrightarrow{{{t^o}}}$ 3Fe + 4H2O
0,015 → 0,06 → 0,045 mol
Fe + 2HCl → FeCl2 + H2
0,045 mol → 0,045 mol
$ = > {V_{{H_2}}} = 0,045.22,4 = 1,008$ lít (phù hợp đầu bài)
Vậy oxit cần tìm là Fe3O4
Hướng dẫn giải:
TH1: M không phải là Fe3O4
M2On + nH2 $\xrightarrow{{{t^o}}}$ 2M + nH2O
+) Tính số mol M2On theo số mol H2
$ = > {M_{{M_2}{O_n}}} = \dfrac{{m}}{n} = 58n$
+) lập bảng, biện luận
TH2: M là Fe3O4 $ = > {n_{F{{\text{e}}_3}{O_4}}}$
Fe3O4 + 4H2 $\xrightarrow{{{t^o}}}$ 3Fe + 4H2O
+) Tính số mol Fe theo số mol Fe3O4
Fe + 2HCl → FeCl2 + H2
+) Tính số mol H2 theo số mol Fe

