Hòa tan hoàn toàn m gam hỗn hợp gồm CuSO4 và FeCl3 vào nước dư thu được dung dịch X. Điện phân dung dịch X với điện cực trơ đến khi ở anot thoát ra 0,2 mol hỗn hợp khí có tỉ khối hơi so với H2 bằng 30,625 thì dừng lại. Dung dịch thu được sau điện phân có chứa 2 muối có nồng độ mol bằng nhau. Giả sử hiệu suất của quá trình điện phân là 100%, khí sinh ra không tan trong dung dịch. Giá trị của m là
Trả lời bởi giáo viên
Hai khí thoát ra ở anot là Cl2 và O2:
Ta có hệ phương trình:
\(\left\{ \begin{gathered}
\sum {{n_{hh}} = {n_{C{l_2}}} + {n_{{O_2}}} = 0,2} \hfill \\
\sum {{m_{hh}} = 71{n_{C{l_2}}} + 32{n_{{O_2}}} = 30,625.2.0,2} \hfill \\
\end{gathered} \right. \Rightarrow \left\{ \begin{gathered}
{n_{C{l_2}}} = 0,15 \hfill \\
{n_{{O_2}}} = 0,05 \hfill \\
\end{gathered} \right.\)
Sau phản ứng thu được 2 muối có nồng độ bằng nhau → số mol 2 muối bằng nhau
→ Fe3+ điện phân hết, Cu2+ điện phân dư
BTNT "Cl": 3nFeCl3 = 2nCl2 → nFeCl3 = 2/3. 0,15 = 0,1 (mol)
→ nCu2+ dư = nFe2+ = nFe3+ = 0,1 (mol)
Đặt nCu2+ điện phân = a (mol)
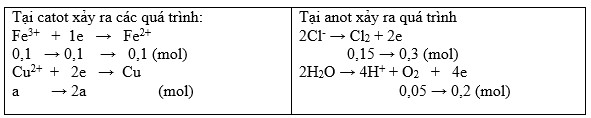
BT e ta có: 0,1 + 2a = 0,3 + 0,2 → a = 0,2 (mol)
BTNT "Cu": nCuSO4 = nCu2+ điện phân + nCu2+ dư = 0,2 + 0,1 = 0,3 (mol)
→ m = mCuSO4 + mFeCl3 = 0,3.160 + 0,1.162,5 = 64,25 (g)
Hướng dẫn giải:
Hai khí thoát ra ở anot là Cl2 và O2:
Ta có hệ phương trình: \(\left\{ \begin{gathered}\sum {{n_{hh}} = {n_{C{l_2}}} + {n_{{O_2}}} = 0,2} \hfill \\\sum {{m_{hh}} = 71{n_{C{l_2}}} + 32{n_{{O_2}}} = 30,625.2.0,2} \hfill \\ \end{gathered} \right. \Rightarrow \left\{ \begin{gathered}{n_{C{l_2}}} = ? \hfill \\{n_{{O_2}}} = ? \hfill \\ \end{gathered} \right.\)
Sau phản ứng thu được 2 muối có nồng độ bằng nhau → số mol 2 muối bằng nhau
→ Fe3+ điện phân hết, Cu2+ điện phân dư
BTNT "Cl" → nFeCl3 = 2/3nCl2 = ? (mol)
nCu2+ dư = nFe2+ = nFe3+ = ?
Viết các bán phản ứng xảy ra ở mỗi điện cực, dùng bảo toàn e sẽ tính được mol Cu2+ điện phân
BTNT "Cu": nCuSO4 = nCu2+ dư + nCu2+ điện phân

