Lý thuyết: Xu hướng biến đổi thành phần và một số tính chất của hợp chất trong một chu kì
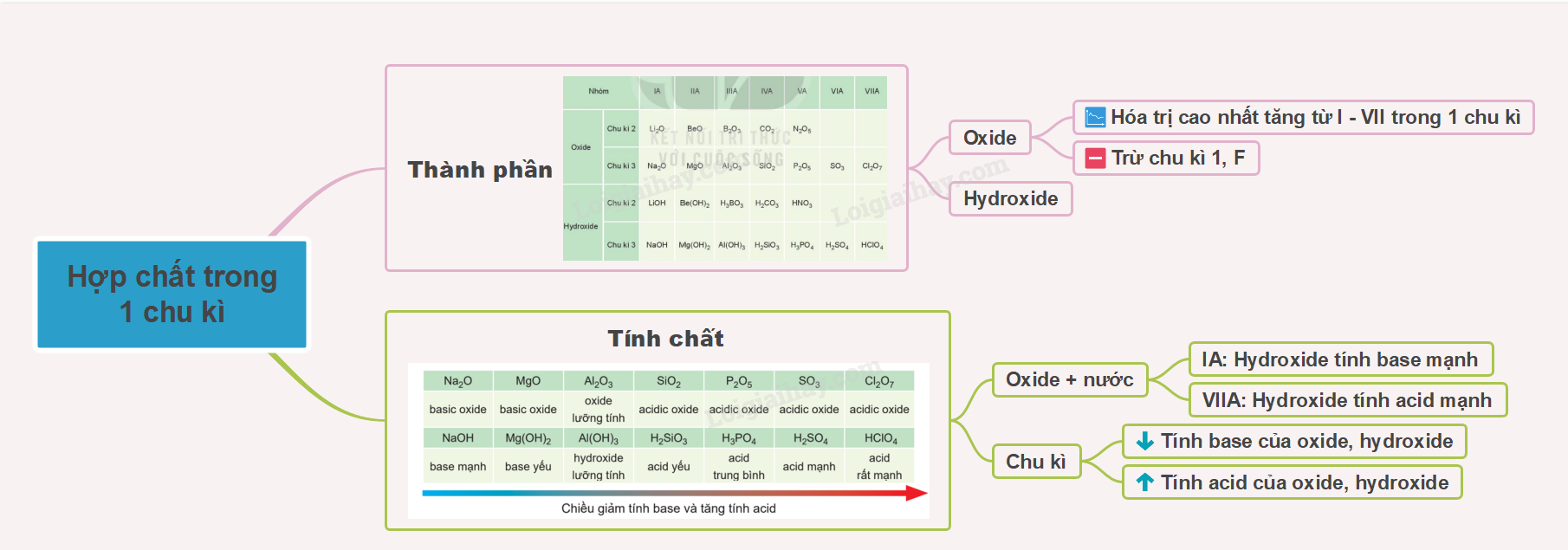
I. Thành phần của các oxide và hydroxide
- Hóa trị cao nhất của các nguyên tố nhóm A trong hợp chất với oxygen tăng từ I đến VII khi đi từ trái qua phải trong một chu kì (trừ chu kì 1 và nguyên tố fluorine ở chu kì 2), do đó thành phần của các oxide và hydroxide có sự lặp lại theo chu kì
Công thức oxide, hydroxide với hóa trị cao nhất ở chu kì 2, 3
II. Tính chất của oxide và hydroxide
1. Phản ứng của oxide với nước
- Trong một thí nghiệm, cho các oxide Na2O, MgO, P2O5 vào nước, nhúng giấy quỳ tím vào dung dịch sau phản ứng. Hiện tượng phản ứng được trình bày trong bảng sau:
| Oxide | Hiện tượng |
| Na2O | Tan hoàn toàn trong nước. Quỳ tím chuyển màu xanh đậm. |
| MgO | Tan một phần trong nước. Quỳ tím chuyển màu xanh nhạt. |
| P2O5 | Tan hoàn toàn trong nước. Quỳ tím chuyển màu đỏ. |
Phương trình phản ứng
Na2O + H2O → 2NaOH
MgO + H2O → Mg(OH)2
P2O5 + 3H2O → 2H3PO4
2. Phản ứng của muối với dung dịch acid
- Chuẩn bị: dung dịch Na2CO3 vào ống nghiệm chứa dung dịch HNO3
- Hiện tượng: sủi bọt khí CO2
- Phương trình phản ứng:
Na2CO3 + 2HNO3 → 2NaNO3 + CO2 + H2O
- Các oxide khi tác dụng với nước tạo thành hydroxide của các nguyên tố nhóm IA thể hiện tính base mạng, hydroxide ứng với hóa trị cao nhất của các nguyên tố nhóm VIIA (trừ fluorine) thể hiện tính acid mạnh
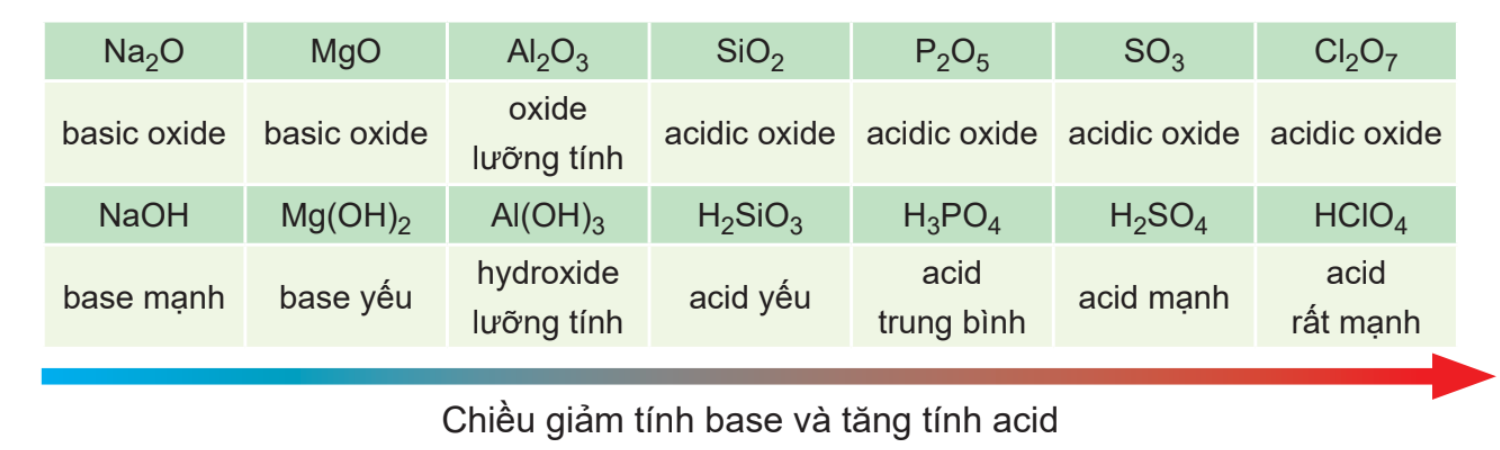
- Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân, tính base của oxide và hydroxide tương ứng giảm dần, đồng thời tính acid của chúng tăng dần