Làm lạnh 160 gam dung dịch bão hòa muối RSO4 30% xuống tới nhiệt độ 200C thì thấy có 28,552 gam tinh thể RSO4.nH2O tách ra. Biết độ tan của RSO4 ở 20oC là 35 gam. Xác định công thức của tinh thể RSO4.nH2O biết R là kim loại; n là số nguyên và 5 < n < 9.
Trả lời bởi giáo viên
\({m_{RSO4(bd)}} = \dfrac{{30}}{{100}}.160 = 48(gam)\)
mdd bão hòa (sau khi kết tinh) = 160 - 28,552 = 131,478 gam
Ở 20oC: SRSO4 = 35 gam, ta có:
mRSO4 (dd 20oC) = \(\dfrac{{35}}{{135}}.131,478 = 34,087gam\)
Khối lượng RSO4 trong RSO4.nH2O bị kết tinh là:
mRSO4 (kt) = mRSO4 (ban đầu) - mRSO4 (20 độ) = 48 - 34,087 = 13,913 gam
Xét phân tử RSO4.nH2O ta có:
\(\dfrac{{{m_{RSO4}}}}{{{m_{H2O}}}} = \dfrac{{R + 96}}{{18n}} = \dfrac{{13,913}}{{28,552 - 13,913}} \to R = 17,142n - 96\)
Biện luận:
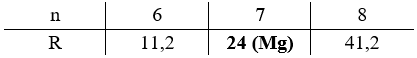
Vậy công thức của muối ngậm nước là MgSO4.7H2O.
Hướng dẫn giải:
Tính mRSO4 ban đầu, mddbh (sau khi kết tinh).
Ở 20oC: SRSO4 = 35 gam, ta có mRSO4 (dd 200C).
Khối lượng RSO4 trong RSO4.nH2O bị kết tinh là:
mRSO4 (kt) = mRSO4 (ban đầu) - mRSO4 (20 độ)
Xét phân tử RSO4.nH2O ta có:
\(\dfrac{{{m_{RSO4}}}}{{{m_{H2O}}}} = \dfrac{{R + 96}}{{18n}}\) → Mối liên hệ giữa R và n
Biện luận R và n → Công thức của muối ngậm nước.