Hòa tan hoàn toàn hỗn hợp gồm 0,25 mol Al2O3 và 0,4 mol BaO vào nước dư thu được dung dịch E. Nhỏ từ từ dung dịch HCl k (M) vào E, số mol kết tủa (y mol) thu được phụ thuộc vào số mol HCl phản ứng (x mol) được biểu diễn theo sơ đồ sau:
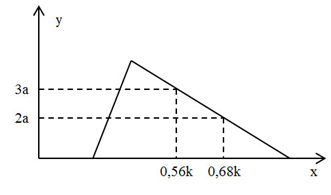
Giá trị của k là:
Trả lời bởi giáo viên
BaO + H2O → Ba(OH)2
Mol 0,4 → 0,4
Al2O3 + Ba(OH)2 → Ba(AlO2)2 + H2O
Mol 0,25 → 0,25 → 0,25
=> số mol Ba(OH)2 dư = 0,4 – 0,25 = 0,15 mol
Vậy dung dịch E gồm: 0,3 mol OH- ; 0,5 mol AlO22- và Ba2+
Các phản ứng có thể xảy ra:
OH- + H+ → H2O
H+ + AlO2- + H2O → Al(OH)3
Al(OH)3 + 3H+ → Al3+ + 3H2O
Tại nHCl = 0,56k (mol) và 0,68k (mol) đều ở bên phải của đỉnh kết tủa (kết tủa max)
=> Lúc này, có sự hòa tan kết tủa bởi HCl nên ta sử dụng công thức:
nH+ = nOH- + 4nAlO2- - 3nAl(OH)3 => nAl(OH)3 = 1/3.[4nAlO2 - (nH+ - nOH)]
+ Tại nHCl = 0,56k (mol) => nAl(OH)3 = 3a (mol) = 1/3.[4nAlO2 - (nH+ - nOH)]
=> 3a.3 = 4.0,5 – (0,56k – 0,3) (1)
+ Tại nHCl = 0,68k (mol) => nAl(OH)3 = 2a (mol) = 1/3.[4nAlO2 - (nH+ - nOH)]
=> 2a.3 = 4.0,5 – (0,68k – 0,3) (2)
Giải hệ (1) và (2) => k = 2,5 (M)
Hướng dẫn giải:
Nếu cho H+ tác dụng với dung dịch [Al(OH)4]- thì xảy ra 1 hoặc 2 phản ứng sau:
[Al(OH)4]- + H+ → Al(OH)3 + H2O (1)
Al(OH)3 + 3H+ → Al3+ + 3H2O (2)
*Phương pháp: Nếu đặt: n[Al(OH)4]- = a mol; nH+ = b mol thì:
+ Nếu b/a 1 thì: nAl(OH)3 = b
+ Nếu 1 < b/a < 4 thì kết tủa bị hoà tan 1 phần và: nAl(OH)3 = (4a – b)/3
+ Nếu b/a 4 thì không có kết tủa

