Nung nóng a mol hỗn hợp X gồm C2H2 và H2 trong bình kín có xúc tác thích hợp thu được hỗn hợp khí Y. Dẫn Y qua lượng dư dung dịch AgNO3 trong NH3, sau khi phản ứng hoàn toàn thu được 24 gam kết tủa và hỗn hợp khí Z. Hỗn hợp Z làm mất màu tối đa 40 gam brom trong dung dịch và còn lại hỗn hợp khí T. Đốt cháy hoàn toàn hỗn hợp T thu được 11,7 gam nước. Giá trị của a là:
Trả lời bởi giáo viên
C2H2 + 2H2 → C2H6
C2H2 + H2 → C2H4
Trong Y có C2H2, tạo kết tủa Ag2C2 => ${{n}_{A{{g}_{2}}{{C}_{2}}}}=0,1\,mol$
$\Rightarrow {{n}_{{{C}_{2}}{{H}_{2}}(Y)}}=0,1\,mol$
Z làm mất màu dung dịch Br2 => Z chứa C2H4
$=>{{n}_{{{C}_{2}}{{H}_{4}}}}={{n}_{B{{\text{r}}_{2}}}}=0,25\,mol$
Còn lại hỗn hợp khí T gồm C2H6 và H2
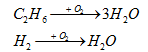
=> ${{n}_{{{H}_{2}}O}}=3.{{n}_{{{C}_{3}}{{H}_{6}}}}+{{n}_{{{H}_{2}}}}$ dư = 0,65 (1)
Bảo toàn nguyên tố C ta có: ${{n}_{{{C}_{2}}{{H}_{2}}}}$ bđầu $={{n}_{{{C}_{2}}{{H}_{2}}\text{ }du}}+\text{ }{{n}_{{{C}_{2}}{{H}_{4}}}}+\text{ }{{n}_{{{C}_{2}}{{H}_{6}}}}$
${{n}_{{{H}_{2}}}}$ ban đầu $={{n}_{{{H}_{2}}\text{ }du}}+{{n}_{{{C}_{2}}{{H}_{4}}}}+2.{{n}_{{{C}_{2}}{{H}_{6}}}}$
Cộng 2 vế phương trình ta có:
$~a={{n}_{{{C}_{2}}{{H}_{2}}\text{ }du}}+2.{{n}_{{{C}_{2}}{{H}_{4}}}}+3.{{n}_{{{C}_{2}}{{H}_{6}}}}+{{n}_{{{H}_{2}}}}_{du}~$
Thay (1) vào => a = 0,1 + 0,25.2 + 0,65 = 1,25
Hướng dẫn giải:
+) Trong Y có C2H2, tạo kết tủa Ag2C2 $\Rightarrow {{n}_{{{C}_{2}}{{H}_{2}}}}$
Z làm mất màu dung dịch Br2 => Z chứa C2H4 $=>{{n}_{{{C}_{2}}{{H}_{4}}}}={{n}_{B{{\text{r}}_{2}}}}$
Còn lại hỗn hợp khí T gồm C2H6 và H2
${{n}_{{{H}_{2}}O}}=3.{{n}_{{{C}_{3}}{{H}_{6}}}}+{{n}_{{{H}_{2}}}}$ dư
${{n}_{{{C}_{2}}{{H}_{2}}}}$ bđầu $={{n}_{{{C}_{2}}{{H}_{2}}\text{ }du}}+\text{ }{{n}_{{{C}_{2}}{{H}_{4}}}}+\text{ }{{n}_{{{C}_{2}}{{H}_{6}}}}$
${{n}_{{{H}_{2}}}}$ ban đầu $={{n}_{{{H}_{2}}\text{ }du}}+{{n}_{{{C}_{2}}{{H}_{4}}}}+2.{{n}_{{{C}_{2}}{{H}_{6}}}}$
Cộng 2 vế phương trình ta có:
$~a={{n}_{{{C}_{2}}{{H}_{2}}\text{ }du}}+2.{{n}_{{{C}_{2}}{{H}_{4}}}}+3.{{n}_{{{C}_{2}}{{H}_{6}}}}+{{n}_{{{H}_{2}}}}_{du}~$ => a

