Nung 0,935 gam quặng cromit với chất oxi hóa để oxi hóa toàn bộ crom thành CrO42-. Hòa tan sản phẩm vào nước, phân hủy hết chất oxi hóa, axit hóa dung dịch bằng H2SO4 rồi thêm 50,0 ml dung dịch FeSO4 0,08M vào. Để chuẩn độ FeSO4 dư cần 14,85 ml dung dịch KMnO4 0,004M. Hàm lượng crom có trong quặng là
Trả lời bởi giáo viên
Bước 1: Tính nFeSO4, nKMnO4
\({n_{F{{\rm{e}}^{2 + }}\left( {b{\rm{d}}} \right)}} = 0,05.0,08 = 0,004\left( {mol} \right)\)
\({n_{KMn{O_4}}} = 0,01485.0,004 = 5,{94.10^{ - 5}}\left( {mol} \right)\)
Bước 2: Tính nCrO42-
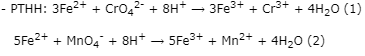
Theo (2) ⟹ nFe2+(dư) = 5.nMnO4- = 5.5,94.10-5 = 2,97.10-4 (mol)
⟹ nFe2+(pư) = 0,004 - 2,97.10-4 = 3,703.10-3 (mol)
Theo (1) ⟹ nCrO42- = 1/3.nFe2+(pư) = 1/3.3,703.10-3 = 1,23433.10-3 (mol)
⟹ mCr = 1,23433.10-3.52 = 0,064 gam.
Bước 3: Tính hàm lượng Crom trong quặng cromit
- %mCr = \(\dfrac{{0,064}}{{0,935}}.100\% \) = 6,845%.
Hướng dẫn giải:
Bước 1: Tính nFeSO4, nKMnO4
Bước 2: Tính nCrO42-
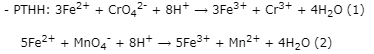
- Tính nFe2+ p/ư ⟹ nCrO42- = 1/3.nFe2+(pư)
⟹ mCr = nCrO42- . 52
Bước 3: Tính hàm lượng Crom trong quặng cromit
- %mCr = (mCr /0,935).100%

