Hỗn hợp X gồm N2 và H2 có ${{\overline{M}}_{X}}=12,4.$ Dẫn X đi qua bình đựng bột Fe rồi nung nóng biết rằng hiệu suất tổng hợp NH3 đạt 40% thì thu được hỗn hợp Y. ${{\overline{M}}_{Y}}$ có giá trị là
Trả lời bởi giáo viên
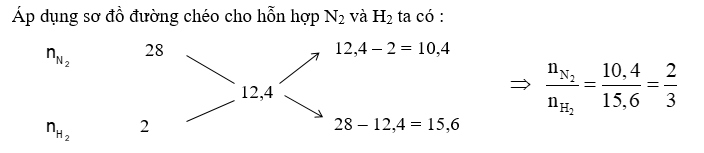
Với tỉ lệ trên suy ra H2 thiếu, hiệu suất phản ứng tính theo H2.
Trong hỗn hợp X ta chọn nN2 = 2 mol và nH2 = 3 mol
=> nH2 phản ứng = 3.40% = 1,2 mol => nN2 phản ứng = 0,4 mol, nNH3 sinh ra = 0,8 mol
nkhí giảm = (1,2 + 0,4) – 0,8 = 0,8 mol
=> \({n_Y} = {n_X} - 0,8 = 2 + 3 - 0,8 = 4,2\,\,mol\)
Theo định luật bảo toàn khối lượng ta có :
\({m_Y} = {m_X} = {m_{{N_2}}} + {m_{{H_2}}} = 2.28 + 3.2 = 62\,\,gam\)
Vậy \({\overline M _Y} = \frac{{{m_Y}}}{{{n_Y}}} = \frac{{62}}{{4,2}} = 14,76\)
Hướng dẫn giải:
+) Áp dụng sơ đồ đường ché => tỉ lệ N2 : H2 => hiệu suất phản ứng tính theo chất thiếu
+) Chọn số mol N2 và H2 => nH2 phản ứng => nN2 phản ứng và nNH3 sinh ra
+) Tính nkhí giảm => nY = nX – ngiảm
+) Theo định luật bảo toàn khối lượng ta có : \({m_Y} = {m_X} = {m_{{N_2}}} + {m_{{H_2}}}\)=> \({\overline M _Y} = \frac{{{m_Y}}}{{{n_Y}}}\)

