Hòa tan hết 28,16 gam hỗn hợp rắn X gồm Mg, Fe3O4 và FeCO3 vào dung dịch chứa H2SO4 và NaNO3, thu được 4,48 lít (đktc) hỗn hợp khí Y (gồm CO2, NO, N2, H2) có khối lượng 5,14 gam và dung dịch Z chỉ chứa các muối trung hòa. Dung dịch Z phản ứng tối đa với 1,285 mol NaOH, thu được 43,34 gam kết tủa và 0,56 lít khí (đktc). Mặt khác, cho dung dịch Z tác dụng với lượng dư dung dịch BaCl2 thu được 166,595 gam kết tủa. Biết các phản ứng xảy ra hoàn toàn. Phần trăm khối lượng Mg trong X là
Trả lời bởi giáo viên
Khi cho dung dịch Z tác dụng với BaCl2 dư thì kết tủa thu được là BaSO4
\( \to {n_{BaS{O_4}}} = \dfrac{{166,595}}{{233}} = 0,715\,\,mol\)
Bảo toàn gốc \(SO_4^{2 - } \to {n_{{H_2}S{O_4}}} = 0,715\,\,mol\)
Khi cho Z tác dụng với NaOH vừa đủ thu được khí là NH3
\({n_{N{H_3}}} = \dfrac{{0,56}}{{22,4}} = 0,025\,\,mol \to {n_{NH_4^ + }} = 0,025\,\,mol\)
Bảo toàn điện tích cho dung dịch Z: \(2{n_{M{g^{2 + }}}} + 2{n_{F{e^{2 + }}}} + 3{n_{F{e^{3 + }}}} + {n_{NH_4^ + }} + {n_{N{a^ + }}} = 2{n_{SO_4^{2 - }}}\)
Mà \({n_{NaOH}} = 2{n_{M{g^{2 + }}}} + 2{n_{F{e^{2 + }}}} + 3{n_{F{e^{3 + }}}} + {n_{NH_4^ + }} = 1,285\,\,mol\)
\( \to 1,285 + {n_{N{a^ + }}} = 2.0,715 \to {n_{N{a^ + }}} = 0,145\,\,mol\)
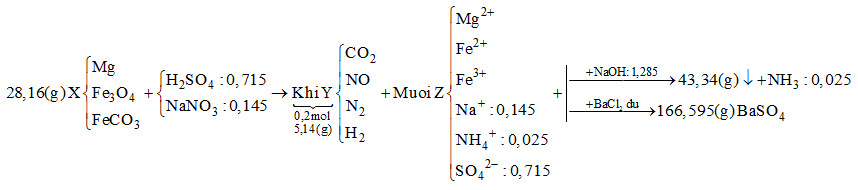
Ta có: \({n_{O{H^ - }\,\,(trong\,\,hidroxit)}} + {n_{NH_4^ + }} = {n_{NaOH}} \to {n_{O{H^ - }\,\,(trong\,\,hidroxit)}} = 1,285 - 0,025 = 1,26\,\,mol\)
Bảo toàn khối lượng: \({m_{Fe}} + {m_{Mg}} + {m_{O{H^ - }\,\,(trong\,\,hidroxit)}} = 43,34 \to {m_{Fe}} + {m_{Mg}} + 1,26.17 = 43,34\)
\( \to {m_{Fe}} + {m_{Mg}} = 21,92g\)
Bảo toàn khối lượng cho dung dịch Z: \({m_{Mg}} + {m_{Fe}} + {m_{Na}} + {m_{NH_4^ + }} + {m_{SO_4^{2 - }}} = 21,92 + 0,145.23 + 0,025.18 + 0,715.96 = 94,345g\)
Bảo toàn khối lượng cho phản ứng: \({m_X} + {m_{{H_2}S{O_4}}} + {m_{NaN{O_3}}} = {m_Z} + {m_Y} + {m_{{H_2}O}}\)
\( \to 28,16 + 0,715.98 + 0,145.85 = 94,345 + 5,14 + {m_{{H_2}O}}\)
\( \to \) \({m_{{H_2}O}} = 14,07g \to {n_{{H_2}O}} = 0,615\,\,mol\)
Bảo toàn nguyên tố H : \(2{n_{{H_2}S{O_4}}} = 2{n_{{H_2}}} + 4{n_{NH_4^ + }} + 2{n_{{H_2}O}}\)
\( \to 2.0,715 = 2{n_{{H_2}}} + 4.0,025 + 2.0,615 \to {n_{{H_2}}} = 0,05\,\,mol\)
Đặt số mol của CO2, NO và N2 lần lượt là x, y, z
\( \to x + y + z + 0,05 = 0,2 \to x + y + z = 0,15\) (*)
Tổng khối lượng Y là 5,14 \( \to 44x + 30y + 28z + 0,05.2 = 5,14\)
\( \to 44x + 30y + 28z = 5,04\) (**)
Bảo toàn nguyên tố N : \({n_{NaN{O_3}}} = {n_{NO}} + 2{n_{{N_2}}} + {n_{NH_4^ + }} \to 0,145 = y + 2z + 0,025\)
\( \to y + 2z = 0,12\) (***)
Từ (*), (**) và (***) \( \to \) x = 0,04; y = 0,01; z = 0,04
\( \to {n_{FeC{O_3}}} = 0,04\,\,mol\)
Gọi số mol của Mg và Fe3O4 lần lượt là a và b
\( \to 24a + 232b + 116.0,04 = 28,16 \to 24a + 232b = 23,52\) (1)
Vì tổng khối lượng của Mg và Fe trong hỗn hợp X là 21,92g
\( \to 24a + 56.(3b + 0,04) = 21,92 \to 24a + 168b = 19,68\) (2)
Từ (1) và (2) \( \to \) a = 0,4; b = 0,06
\( \to \% {m_{Mg}} = \dfrac{{0.4.24}}{{28,16}}.100\% = 34,09\% \)
Hướng dẫn giải:
Bảo toàn khối lượng, bảo toàn nguyên tố, bảo toàn điện tích.

