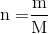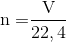Cho sắt tác dụng với dung dịch axit H2SO4 theo sơ đồ sau: Fe + H2SO4 → FeSO4 + H2. Có 22,4 gam sắt tác dụng với 24,5 gam H2SO4. Thể tích khí H2 thu được ở đktc là
Trả lời bởi giáo viên
Số mol Fe là: ${n_{F{\text{e}}}} = \dfrac{{22,4}}{{56}} = 0,4\,mol$
Số mol H2SO4 là: ${n_{{H_2}S{O_4}}} = \dfrac{m}{M} = \dfrac{{24,5}}{{2 + 32 + 16.4}} = 0,25\,mol$
PTHH: Fe + H2SO4 → FeSO4 + H2
Xét tỉ lệ: $\dfrac{{{n_{F{\text{e}}}}}}{1} = \dfrac{{0,4}}{1} = 0,4$ và $\dfrac{{{n_{{H_2}S{O_4}}}}}{1} = \dfrac{{0,25}}{1} = 0,25$
Vì 0,25 < 0,4 => Fe dư, H2SO4 phản ứng hết
=> tính số mol H2 theo H2SO4
PTHH: Fe + H2SO4 → FeSO4 + H2
1mol 1mol
0,25 mol → 0,25 mol
=> Thể tích khí H2 thu được ở đktc là: V = 22,4.n = 22,4.0,25 = 5,6 lít
Hướng dẫn giải:
+) Tính số mol Fe và số mol H2SO4
+) Viết PTHH
+) Xét tỉ lệ: $\dfrac{{{n_{F{\text{e}}}}}}{1}$ và $\dfrac{{{n_{{H_2}S{O_4}}}}}{1}$ => chất dư và chất hết
=> tính số mol H2 theo chất hết