Cho hỗn hợp X gồm CuCl2 và FeCl3. Điện phân dung dịch chứa m gam hỗn hợp X với điện cực trơ, cường độ dòng điện 2,68A, trong thời gian là 4 giờ. Sau khi kết thúc điện phân thu được dung dịch Y có khối lượng giảm 20,6 gam so với trước khi điện phân. Toàn bộ dung dịch Y tác dụng với lượng dư dung dịch AgNO3 thu được 136,4 gam kết tủa. Mặt khác cho 14,88 gam bột Mg vào dung dịch chứa m gam hỗn hợp X ban đầu. Kết thúc phản ứng thu được m' gam kim loại. Giá trị của m' là
Trả lời bởi giáo viên
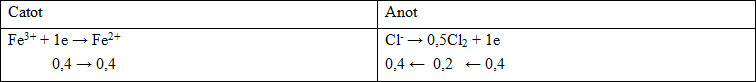
- ne = 0,4 mol => nCl- pư = 0,4 mol => nCl2 = 0,2 mol
=> mCu = 20,6 - 0,2.71 = 6,4 gam => nCu = 0,1 mol
=> mFe3+ = 0,4 - 0,1.2 = 0,2 mol => nAg = 0,2 mol
=> nAgCl = (136,4 - 0,2.108)/143,5 = 0,8 mol
BTNT "Cl" => X chứa CuCl2 (0,8 mol) < 2nMg => Mg dư
- Kim loại thu được gồm: Mg dư, Cu (0,3 mol), Fe (0,2 mol).
=> m' = 14,88 + 0,3.64 + 0,2.56 - 0,6.24 = 30,88 gam
Giải thích thêm:
n e = It/F = 2,68.4.3600/96500 = 0,4 mol
Thứ tự điện phân:
(1) FeCl3 → FeCl2 + 0,5 Cl2
(2) CuCl2 → Cu + Cl2
(3) FeCl2 → Fe + Cl2
Do dung dịch Y tác dụng với AgNO3 thu được kết tủa nên suy ra dung dịch Y chứa Fe2+ và Cl-.
Đặt số mol ban đầu của CuCl2 và FeCl3 lần lượt là x và y (mol)
TH1: Chỉ xảy ra (1)

m dd giảm = mCl2 = 0,2.71 = 14,2 gam ≠ 20,6 gam (loại)
TH2: Xảy ra (1) và (2)
m dd giảm = mCu + mCl2 => 64(0,2-0,5y) + 0,2.71 = 136,4 => y = 3,41875 > 0,4 (loại)
TH3: Xảy ra (1) (2) (3)

+ m dd giảm = mCu + mFe + mCl2 => 64x + 56(0,2-0,5y-x) + 0,2.71 = 20,6 (1)
+ nCl- dư = 2x + 3y - 0,4 (mol); nFe2+ dư = y - (0,2-0,5y-x) = x + 1,5y - 0,2 (mol)
=> mAgCl = nCl- = 2x + 3y - 0,4 (mol); nAg = nFe2+ = x + 1,5y - 0,2 (mol)
=> m kết tủa = 143,5(2x + 3y - 0,4) + 108(x + 1,5y - 0,2) = 136,4 (2)
Giải (1) và (2) được x = 1992/9875 và y = 2262/9875 (loại vì khi đó nFe < 0)
Vậy không có trường hợp nào thỏa mãn.

