Cho hỗn hợp X gồm Fe, FeS, FeS2 tác dụng hoàn toàn với H2SO4 đặc vừa đủ, thu được dung dịch Y và 23,52 lít khí SO2 (đktc). Cho dung dịch Y tác dụng với NaOH dư thu được kết tủa Z. Nung kết tủa Z đến khối lượng không đổi thu được 16 gam chất rắn. Khối lượng hỗn hợp X là
Trả lời bởi giáo viên
Quy đổi hỗn hợp X về Fe và S với số mol lần lượt là x và y mol
$X\,\,\left\{ \begin{gathered}Fe:x\,\,mol \hfill \\S:y\,\,mol \hfill \\ \end{gathered} \right.\,\,\xrightarrow{{ + \,{H_2}S{O_4}}}\,\,Y\,\left\{\begin{gathered}F{e_2}{(S{O_4})_3} \hfill \\S{O_2} \hfill \\ \end{gathered} \right.\,\,\xrightarrow{{ + \,NaOH}}\,\,Z\,\left\{ {Fe{{(OH)}_3} \downarrow \,\,\xrightarrow{{{t^o}}}} \right.\,\,F{e_2}{O_3}$
${n_{S{O_2}}} = \,\,\frac{{23,52}}{{22,4}}\,\, = \,\,1,05\,\,mol$
Xét quá trình cho – nhận e:
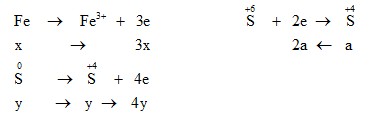
Bảo toàn e : ne cho = ne nhận → 3x + 4y = 2a (1)
${n_{S{O_2}}}$ = ${n_{S{O_2}\,(1)}} + {n_{S{O_2}\,(2)}}$ → y + a = 1,05 (2)
${n_{F{e_2}{O_3}}} = \,\,\frac{{16}}{{160}}\,\, = \,\,0,1\,mol$ → nFe = 2.0,1 = 0,2 mol → x = 0,2 (3)
Từ (1), (2), (3) → x = 0,2; y = 0,25; a = 0,8
→ mhỗn hợp X = mFe + mS = 56.0,2 + 32.0,25 = 19,2gam
Hướng dẫn giải:
$X\,\,\left\{ \begin{gathered}Fe:x\,\,mol \hfill \\S:y\,\,mol \hfill \\ \end{gathered} \right.\,\,\xrightarrow{{ + \,{H_2}S{O_4}}}\,\,Y\,\left\{\begin{gathered}F{e_2}{(S{O_4})_3} \hfill \\S{O_2} \hfill \\ \end{gathered} \right.\,\,\xrightarrow{{ + \,NaOH}}\,\,Z\,\left\{ {Fe{{(OH)}_3} \downarrow \,\,\xrightarrow{{{t^o}}}} \right.\,\,F{e_2}{O_3}$
+) Bảo toàn e : ne cho = ne nhận → PT(1)
${n_{S{O_2}}}$ = ${n_{S{O_2}\,(1)}} + {n_{S{O_2}\,(2)}}$ → PT(2)
+) Tính nFe => PT(3)
+) Giải hệ phương trình => tính khối lượng hỗn hợp

