Thực hiện phản ứng tổng hợp amoniac từ N2 và H2 với hiệu suất h%, thu được hỗn hợp X chứa 10% NH3 (về thể tích). Cho X tác dụng với CuO dư, nung nóng. Sau khi phản ứng xảy ra hoàn toàn, thu được hỗn hợp Y (gồm khí và hơi) và hỗn hợp rắn Z có khối lượng giảm đi so với khối lượng CuO ban đầu là 12,8 gam. Làm lạnh Y còn 6,72 lít khí (đktc) không bị ngưng tụ. Giá trị của h là
Trả lời bởi giáo viên
Bước 1: Viết sơ đồ tóm tắt đề bài
- X tác dụng với CuO tạo chất rắn Z giảm đi so với CuO ban đầu ⟹ Có khí H2 dư.
Sau khi làm lạnh Y còn 6,72 lit (đktc) không bị ngưng tụ ⟹ Có khí N2 dư.
- Sơ đồ đề bài:
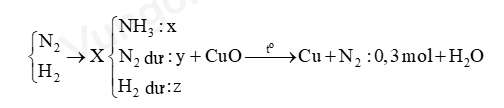
Bước 2: Tính số mol các chất trong X
- mchất rắn giảm = 12,8 gam = m[O] trong CuO
⟹ n[O] trong CuO = 0,8 mol = nCuO
- Đặt nNH3 = x mol ; nN2 dư = y mol ; nH2 = z mol
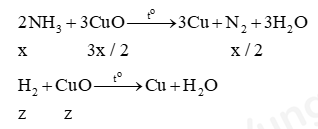
- Lập phương trình tính x, y, z:
(1) Trong hỗn hợp X, NH3 chiếm 10%: $\dfrac{x}{{x + y + z}} = 10\% $
(2) Tổng số mol khí N2: x/2 + y = 0,3
(3) Tổng số mol CuO phản ứng: 3x/2 + z = 0,8
⟹ x = 0,1 ; y = 0,25 ; z = 0,65
Bước 3: Tính hiệu suất phản ứng
- PTHH:
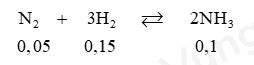
Vì nH2 ban đầu = 0,15 + 0,65 = 0,8 mol ; nN2 ban đầu = 0,05 + 0,25 = 0,3 mol
⟹ Tỉ lệ $\dfrac{{0,8}}{3} < \frac{{0,3}}{1}$ ⟹ Hiệu suất tính theo H2.
⟹ Hiệu suất h = $\dfrac{{0,15}}{{0,15 + 0,65}}.100\% $= 18,75%
Hướng dẫn giải:
Bước 1: Viết sơ đồ tóm tắt đề bài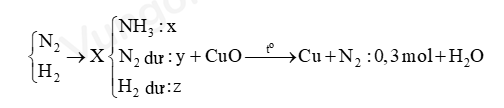
Bước 2: Tính số mol các chất trong X
- Tính nCuO: mchất rắn giảm = m[O] trong CuO
⟹ n[O] trong CuO = nCuO
- Đặt nNH3 = x mol ; nN2 dư = y mol ; nH2 = z mol
Viết PTHH khi X tác dụng với CuO.
- Lập phương trình tính x, y, z:
(1) Trong hỗn hợp X, NH3 chiếm 10%
(2) Tổng số mol khí N2.
(3) Tổng số mol CuO phản ứng.
Bước 3: Tính hiệu suất phản ứng
- Tính nH2 và nN2 theo phản ứng: ${N_2}\,\,\,\,\, + \,\,\,\,\,\,3{H_2}\,\,\,\,\,\,\, \rightleftarrows \,\,\,\,\,\,\,\,2N{H_3}$
⟹ nH2 ban đầu, nN2 ban đầu.
⟹ Xác định hiệu suất tính theo H2 hay N2.
⟹ Hiệu suất = $\dfrac{{{n_{p/ư}}}}{{{n_{ban\,đầu}}}}.100\% $