Làm lạnh 160 gam dung dịch bão hòa muối RSO4 30% xuống tới nhiệt độ 200C thì thấy có 28,552 gam tinh thể RSO4.nH2O tách ra. Biết độ tan của RSO4 ở 20oC là 35 gam. Xác định công thức của tinh thể RSO4.nH2O biết R là kim loại; n là số nguyên và 5 < n < 9.
Trả lời bởi giáo viên
Bước 1: Tính \({m_{RS{O_4}}}\) ban đầu, mdd bão hòa
- \({m_{RSO4(bd)}} = \dfrac{{30}}{{100}}.160 = 48(gam)\)
- mdd bão hòa (sau khi kết tinh) = 160 - 28,552 = 131,478 gam
Bước 2: Tính \({m_{RS{O_4}}}\) ở 20oC, \({m_{RS{O_4}}}\) trong RSO4.nH2O bị kết tinh
- Ở 20oC: SRSO4 = 35 gam, ta có:
mRSO4 (dd 20oC) = \(\dfrac{{35}}{{135}}.131,478 = 34,087gam\)
- Khối lượng RSO4 trong RSO4.nH2O bị kết tinh là:
mRSO4 (kt) = mRSO4 (ban đầu) - mRSO4 (20 độ) = 48 - 34,087 = 13,913 gam
Bước 3: Biện luận tìm CTPT của muối ngậm nước
- Xét phân tử RSO4.nH2O ta có:
\(\dfrac{{{m_{RSO4}}}}{{{m_{H2O}}}} = \dfrac{{R + 96}}{{18n}} = \dfrac{{13,913}}{{28,552 - 13,913}} \to R = 17,142n - 96\)
Biện luận:
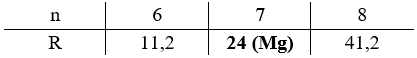
Vậy công thức của muối ngậm nước là MgSO4.7H2O.
Hướng dẫn giải:
Bước 1: Tính \({m_{RS{O_4}}}\) ban đầu, mdd bão hòa
- \({m_{RS{O_4}\,(ban\,dau)}}\, = \,\frac{{C\% }}{{100}}.{m_{{\text{dd}}\,RS{O_4}}}\)
- mdd bão hòa = mdd(ban đầu) – m tinh thể tách ra
Bước 2: Tính \({m_{RS{O_4}}}\) ở 20oC, \({m_{RS{O_4}}}\) trong RSO4.nH2O bị kết tinh
- Ở 20oC: SRSO4= 35 gam, ta có: \({m_{RSO4}}(dd{20^o}C) = {\text{ }}\frac{S}{{100 + S}}.{m_{{\text{dd}}bh}}\)
- Khối lượng RSO4 trong RSO4.nH2O bị kết tinh là: \({m_{RS{O_4}(kt)}} = {\text{ }}{m_{RS{O_4}(ban{\text{ }}dau)}} - {\text{ }}{m_{RS{O_4}({{20}^o}C)}}\)
Bước 3: Biện luận tìm CTPT của muối ngậm nước
- Xét phân tử RSO4.nH2O ta có:
\(\frac{{{m_{RS{O_4}}}}}{{{m_{{H_2}O}}}}\, = \,\frac{{R + 96}}{{18n}},thay\,{m_{RS{O_4}}} = \,R + 96\,\,va\,\,{m_{{H_2}O}}\, = \,18n\, = > \,R\)

